阴阳蛋白质揭示皮肤癌之谜
它开始时很小,只是皮肤上的瑕疵。最常见的痣会保持这种状态-被称为黑素细胞的无害皮肤细胞簇会为我们提供色素。在极少数情况下,从痣开始可能会演变成黑色素瘤,这是人类皮肤癌的最严重类型,因为它可以在全身扩散。
科学家正在使用功能强大的超级计算机来揭示激活约50%黑色素瘤中发现的细胞突变的机制。科学家说,他们希望他们的研究可以帮助人们更好地了解皮肤癌并设计出更好的药物。
在2002年,科学家发现皮肤癌与B-Raf(快速加速纤维肉瘤)激酶的突变之间存在联系,B-Raf激酶是信号链中一部分的蛋白质,该信号从细胞外开始,并进入细胞内部,指导细胞生长。该信号途径称为Ras / Raf / Mek / Erk激酶途径,对癌症研究非常重要,该研究旨在了解失控的细胞生长。根据这项研究,大约50%的黑色素瘤在B-Raf上具有特定的单一突变,称为谷氨酸的缬氨酸600残基(V600E)。
因此,B-Raf V600E成为重要的药物靶标,并且在随后的几年中开发了该突变体的特异性抑制剂。这些药物抑制了该突变体,但发生了一些奇怪的事情。矛盾的是,使突变体安静下来是不利的。它激活了未突变的野生型B-Raf蛋白激酶,再次触发了黑色素瘤。
加州大学伯克利分校约翰·库里安实验室的博士后研究员Yasushi Kondo说:“在这种背景下,我们致力于研究这种重要蛋白质B-Raf的结构。” Kondo是《科学》杂志2019年10月研究的合著者,该研究确定了组成B-Raf的蛋白质复合物的结构,还发现了自相矛盾的B-Raf激活是如何发生的。
“我们旨在研究蛋白质的更天然的状态,以了解其在细胞中的调控方式,因为大多数研究都集中在分离的激酶结构域以及药物如何与激酶结构域结合上。” 近藤说。
全长的B-Raf蛋白由无序区域连接的多个域组成,这对于科学家来说还太笨拙,无法成像。Kondo的技术是使用内含肽化学方法制造较小的片段,然后将其缝合起来以获得完整的结构。
“结果,我们获得了一种活性形式的全长B-Raf二聚体,称为B-Raf,它与14-3-3二聚体(与磷酸化的B-Raf C末端尾部结合的支架蛋白)共纯化,”近藤说。
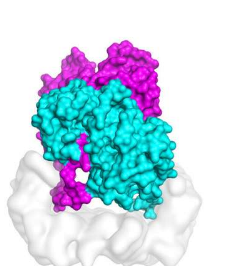
Kondo的研究小组使用冷冻电子显微镜(cryo-EM)来确定B-Raf 14-3-3复合物的结构,基本上是将蛋白质复合物低温冷冻,使其保持在具有化学活性的近乎自然的环境中。接下来,他们用电子束对其进行闪光以获得数千个“冻结帧”。他们筛选出背景噪音并重建了三维密度图,该图显示了分子形状中以前未知的细节。对于蛋白质,形式遵循功能。
近藤解释说,该结构揭示了复合物的不对称组织,该复合物由两组内部对称的二聚体或成对的键合分子形成。Kondo说:“我们认为这种意外的安排能够使B-Raf二聚体不对称活化,这是一种机制,可以解释小分子抑制剂对B-Raf的反常活化的起源。”
德克萨斯高级计算中心的Stampede2超级计算机是国家科学基金会(NSF)资助的极限科学和工程发现环境(XSEDE)的分配资源。信用:TACC
对不对称B-Raf 14-3-3复杂结构的详细分析显示了另一个意外的结构特征,称为一个B-Raf分子的远端尾巴部分,简称DTS。近藤说,一个人的尾巴与另一个人的活性位点结合,通过与ATP结合竞争阻止了它的活性。封闭的B-Raf分子稳定在活性构象中。Kondo说:“我们解释了这种结构,即这种封闭的B-Raf分子起着活化剂的作用,并通过二聚体界面稳定了另一个B-Raf受体。”
颇为奇怪的是,作者将B-Raf二聚体与尾部相连的相互对立的中国阴阳圆形符号进行了比较。“从研究对象的角度来看,很明显一个分子不能磷酸化下游分子,这是细胞生长所必需的。另一个分子显然是能够完成这一工作的分子。在这两个分子的集合中,我们清楚地看到一个是在做辅助工作,另一个是在做实际工作。在我们解决的B-Raf 14-3-3系统中,它确实看起来像阴和阳。
外观虽然可以欺骗。科学家使用计算机模拟来帮助验证它们是否确实存在。该研究的共同作者,约翰·库里扬(John Kuriyan)的博士后研究员Deepti Karandur说:“我们对与14-3-3二聚体结合的B-Raf二聚体复合物进行了分子动力学模拟,”加州大学伯克利分校实验室;她还是霍华德·休斯医学研究所的博士后。卡兰杜尔说:“我们不知道为什么这种构象是不对称的,或者在维持酶的活性状态中起什么作用。”
他们使用Kondo通过cryo-EM解决的结构开始了模拟,DTS区段从一种激酶进入另一种激酶的活性位点。然后他们进行了第二组模拟,删除了DTS段。
Karandur解释说:“我们发现,在没有远端尾段的系统中,整个系统并不稳定。” “激酶结构域相对于支架(14-3-3二聚体)移动。在我们的模拟之一中,B-Raf本身的二聚体状态(实验表明,维持该激酶的活性状态是必要的),分离,表明该远端尾段DTS实际上是将复合物维持在这种不对称构象中所必需的,而这又是将激酶二聚体维持在稳定的不对称二聚体活性状态所必需的。”
这项研究的主要结果之一是发现了一种作用机制,该机制可切换两个B-Raf激酶和两个14-3-3支架蛋白的B-Raf激酶复合物,其中B-Raf激酶为激活剂,并且另一个是接收者。
Kondo说:“ 受体分子的尾部在活化剂的活性位点内,因此活化剂不能作为酶起作用。” “相反,活化剂分子稳定了受体分子的活性构象。14-3-3支架蛋白促进了这种排列,因此尾部插入仅发生在一个激酶分子上。我们假设当没有14-3-3时3结合,两种激酶都可以通过DTS的插入而被阻断,但这需要进行测试。”
这项研究的计算挑战涉及分子动力学模拟,该模拟在原子水平上对蛋白质进行建模,以大约2飞秒的时间步长确定约200,000个原子的系统中每个原子在每个其他原子上的作用力。
卡兰杜尔说:“对于小型系统,我们可以看到相对较快地发生了什么,但是对于像这样的大型系统,尤其是大型生物分子系统,这些变化的发生时间是纳秒级,微秒级甚至是毫秒级。”
Karandur和同事们寻求NSF资助的极限科学和工程发现环境XSEDE在德克萨斯高级计算中心(TACC)的Stampede2超级计算机上分配时间,并在匹兹堡超级计算机中心分配桥梁系统时间。研究该途径中的其他蛋白质。Stampede2的Skylake处理器节点与Intel Omnipath联网,使针对超级计算机进行了优化的NAMD分子动力学仿真快速完成。
“ Stampede2运行非常非常快,而且非常高效。我们在大约四到六周的时间内为我们的系统生成了总计约1.5微秒的轨迹。而如果在我们自己的内部集群中运行它我们几个月或更长时间,” Karandur说。
关于XSEDE,Karandur评论道:“我认为这是一种了不起的资源。从我还是研究生的那一刻起,我就一直在进行模拟。XSEDE使我们能够访问与生物学相关的时间表。在细胞中发生的一切,开始时,我们无法在任何地方的任何系统上运行此仿真,我的意思是,这将花费五年甚至更长的时间。说,好吧,我们知道为什么这很重要,所以我们现在可以开始真正了解生物学的发生方式,真是太神奇了,”卡兰杜尔说。
关于B-Raf仍有很多发现。它只是控制细胞生长和癌症的信号链中的一个环节。
Karandur解释说:“本文所解决的结构是大型多域系统的一部分。” “我们不知道这种完整的蛋白质是什么样子。我们在结构中看不到它。我们也不知道它的动力学是怎样的,蛋白质的所有其他这些部分如何在维持活性中发挥作用状态,或将其从非活动状态转换为活动状态。”
她进一步指出,随着系统变得越来越大,相关的结构变化会在更长的时间范围内发生,并且需要更大的超级计算机来处理复杂性,例如TACC的NSF资助的Frontera超级计算机。
卡伦杜尔说:“ Frontera正到达那里。我们对此感到非常兴奋。我们正在为Frontera分配资金。”
对于非科学家而言,这项基础研究可能会产生见识,从而开发出更好的皮肤癌药物。
Kondo说:“这些B-Raf特异性抑制剂对Raf激酶的反常激活将正常细胞转变为肿瘤。” 了解这种现象的机制将使我们能够设计出更好的药物。希望我们的研究可以帮助您理解这一步骤。此外,我们在激酶结构域和B-Raf分子的14-3-3结合元件之间的此链接中发现了突变,这之前从未显示过。该突变降低了细胞中B-Raf的活性。这也表明激酶结构域的这一部分可以成为开发新型B-Raf抑制剂的目标。”
Karandur说:“单元中发生了很多动态。很大程度上是由于XSEDE,我们才开始能够看到类似的事物。展望未来,我们继续观察事物的唯一方法就是使用非常非常大的超级计算机,因为计算需要大量的计算能力,能够真正看到这些事情发生并说出这是原子级的变化是非常令人兴奋的;这是这两个原子之间的相互作用形式或断裂,并将其转化为蛋白质整体结构在全球范围内的巨大变化,以及它与其他蛋白质或细胞中其他分子相互作用的方式。我们对它在细胞内的位置感到非常兴奋。未来。”
该研究``二聚体B-Raf:14-3-3复合物的Cryo-EM结构揭示了B-Raf激酶活性位点的不对称性'',于2019年10月4日发表在《科学》杂志上。
推荐内容
-
心理咨询之婚恋观——婆媳间不能说的话_哪些话婆媳间不能说
现在的年轻人对于婚姻和爱情大部分是很被动的,他们觉得感情这种事随缘就好,其实一个人也可以过的很精彩。但是没经历过你又怎么知道爱...
-
如何判断心理健康
社会的发展越来越快,大家现在也慢慢开始关注一个人的心理健康。因为外界事物的巨大变化,很多人跟不上变化的脚步就会产生心理落差感从...
-
宝宝照镜子好处多
家家都有本难念的经,特别是有小孩的家庭。在和孩子相处的过程中很多家长都在不断学习,怎么跟孩子交流起来更有效,怎么不跟孩子发脾气...
-
心理咨询之婚恋观——女人相亲应怎么做_女人相亲的秘诀
如果一些还没谈过恋爱的男男女女们不知道该怎么处理异性人际关系可以看下过来人的一些建议,能帮助自己在爱情这条路上少走一些弯路。女...
-
要不要跟前任复合
如果一些还没谈过恋爱的男男女女们不知道该怎么处理异性人际关系可以看下过来人的一些建议,能帮助自己在爱情这条路上少走一些弯路。要...
-
如何处理类固醇诱导的骨质疏松症
糖皮质激素引起的骨质疏松症(GIOP)是一个常见问题,其后果可能是灾难性的,尤其是在人口老龄化和风湿性疾病患者中。医学博士Lenore Buckle
-
研究揭示了急性红细胞白血病的基因组学基础
急性红细胞白血病(AEL)是一种高危癌症,预后不良,遗传基础不确定,围绕诊断存在争议。由于今天出现在Nature Genetics期刊上的St Jude儿
-
《了不起的儿科医生》婷婷的身世怎样的 电视剧讲述了什么
《了不起的儿科医生》婷婷的身世怎样的 电视剧讲述了什么正在热烈播出已经收获了不俗的票房和收视率,从现在放出的预告和最新剧情来看,真
-
男人别送错礼物给老婆_送什么礼物给妻子会生气
现在的年轻人对于婚姻和爱情大部分是很被动的,他们觉得感情这种事随缘就好,其实一个人也可以过的很精彩。但是没经历过你又怎么知道爱...
-
转基因鲑鱼可能是安全的 但他们还没有来到你附近的商店
我们所有人,很可能在不知情的情况下,吃过含有某种形式的转基因作物的产品,尽管已经进行了近二十年的商业化生产,但仍然存在争议。但...