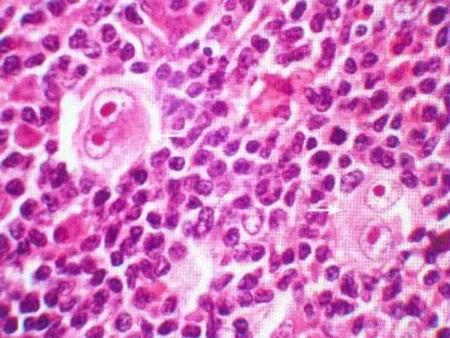
上海药物研究所科学家揭示了GPR160与前列腺癌的相关性
G蛋白偶联受体(GPCR)代表最成功的蛋白质家族作为药物靶标。它们在癌症的发病机制和进展中的作用正在引起越来越多的关注。然而,尚未鉴定出孤儿GPCR的内源性配体,并且它们的生理作用仍然难以捉摸。
前列腺癌目前是男性中最常诊断的非皮肤病恶性肿瘤,也是北美第二大死因。虽然中国的发病率相对低于西方国家,但近年来尤其是晚期前列腺癌的生存率较低。迫切的医疗需求是开发新的治疗剂来对抗这种致命的疾病。
GPR160属于A类GPCR家族。作为孤儿受体,其结构和功能尚不清楚。由Drs领导的研究小组之间进行了合作。国家药物筛选中心王明伟,丁健,中国科学院上海药物研究所,阐明功能孤儿GPCRs。其中,他们发现某些前列腺癌细胞系和组织样本中GPR160的转录水平显着高于正常前列腺细胞和组织中的转录水平。GPR160的敲减导致体外和无胸腺小鼠中前列腺癌细胞的凋亡和生长停滞。在用乱序或靶向GPR160的shRNA慢病毒感染的细胞中将基因的差异表达模式与GeneChip进行比较。差异表达基因的基因本体论和网络分析表明GPR160是细胞因子受体的潜力。用靶向GPR160的shRNA慢病毒或双链siRNA寡核苷酸处理细胞显着提高了IL6和CASP1基因的转录。半胱天冬酶1选择性抑制剂部分拯救了GPR160敲低诱导的细胞凋亡。
这项原创性研究由周彩虹副教授领导,于2016年2月10日在线发表于Oncotarget(DOI:10.18632 / oncotarget.7313)。它首次报道了GPR160与前列腺癌的相关性,从而提供了机会。发现针对GPR160的前列腺癌的新疗法。这项工作部分得到了中国国家卫生和计划生育委员会,中国科学院和上海市科学技术委员会的资助。
摘要:G蛋白偶联受体(GPCR)代表了包括癌症在内的多种疾病的治疗干预中涉及的最大的膜蛋白家族。探索孤儿GPCR的生物学行为可能会导致确定药物发现的新目标。本研究探讨了GPR160(一种孤儿GPCR)在前列腺癌发病机制中的潜在作用。前列腺癌组织样品和细胞系(例如PC-3,LNCaP,DU145和22Rv1细胞)中GPR160的转录水平显着高于正常前列腺组织和细胞中所见的转录水平。通过靶向人GPR160基因(ShGPR160)的慢病毒介导的短发夹RNA构建体敲低GPR160导致前列腺癌细胞凋亡和在体外和无胸腺小鼠中的生长停滞。用ShGPR160或争夺慢病毒感染的PC-3细胞中的差异基因表达模式显示815个基因被激活并且1193个被抑制。差异表达基因(DEGs)的功能注释表明,微管细胞骨架,细胞因子活性,细胞周期阶段和有丝分裂是被抑制基因富集的最明显的功能,而活化基因显着丰富程序性细胞死亡,细胞凋亡和趋化性的调节。 。用靶向GPR160的shRNA慢病毒或双链siRNA寡核苷酸处理细胞显着增加了IL6和CASP1基因的转录。我们的数据表明,内源性GPR160的表达水平与前列腺癌的发病机制有关。
推荐内容
-
心理咨询之婚恋观——丈夫爱沉默,我该怎么办?
爱情和婚姻本身是美好的东西,但是因为每个人处理的方式不同导致结果有好有坏。很多人其实可以少看一些网络案例,毕竟感情这种事是很难...
-
心理咨询之婚恋观——【哪些是孤独终老依恋型】孤独终老依恋型是
每个人对爱情和婚姻或多或少都有自己的想象,但是实际上遇到爱情来临的时候很多人又不知道该怎么处理,所以感情也是门深奥的学问,大家...
-
发现成功的T细胞侵袭肿瘤的关键步骤
路德维希癌症研究中心的研究人员表示,他们已经破译了癌症和免疫细胞之间复杂的分子对话,这对于协调杀死癌细胞的T细胞成功侵入肿瘤至关重
-
《狼殿下》里的朱温是谁演的 炀国皇帝楚馗原型是谁
《狼殿下》里的朱温是谁演的 炀国皇帝楚馗原型是谁,这部剧的制作是很精致的,每个剧的镜头和画面都很细心,小编将为你带来这部剧的相关精
-
跳跃基因的党纪
跳跃基因,转座子,是大多数生物的基因组的一部分,聚集到家族中并且可以通过跳跃来破坏基因组。主机如何抑制跳跃是很好的调查。到目前...
-
生活中怎样有效减压
家家都有本难念的经,特别是有小孩的家庭。在和孩子相处的过程中很多家长都在不断学习,怎么跟孩子交流起来更有效,怎么不跟孩子发脾气...
-
为什么在实体瘤中CAR-T疗效不佳
CAR-T作为免疫疗法的明星产品之一,已经在血液癌症中展现出巨大的实力。但是,对于实体瘤,CAR-T疗法却鲜有成效。作为一种活的药物,CAR-T
-
以及关于男性性细胞的其他令人惊讶的事实
大多数人可能会认为精子就像人类精液中微小的蝌蚪一样扭动着。但是雄性动物产生的精子的大小,形状和数量存在惊人的多样性。事实上,尽...
-
Amgen为癌症合作伙伴Nuevolution提供1.67亿美元
Amgen今天表示计划以约1610亿瑞典克朗(约合1 67亿美元)的价格收购Nuevolution,该公司是其近三年癌症和神经科学治疗合作的合作伙伴。该协议
-
心理咨询之婚恋观——【男人示爱的技巧】男人示爱的无声方式
感情这种事谁都说不准,与其自己一个人瞎猜不如看下经验者是如何应对这些问题的,多一个参考就能避免一些不必要的误会,了解的更多就会...