归巢本能应用于干细胞显示细胞家到心脏组织
我N A世界第一,科学家们发现直接干细胞的心脏组织的新途径。这项研究结果由布里斯托大学的研究人员发表并发表在 化学科学上,可以从根本上改善心血管疾病的治疗方法,导致英国超过四分之一的死亡人数(1)。
迄今为止,使用从患者或供体采集并生长并注入患者心脏以再生受损组织的干细胞的试验已经产生了有希望的结果。
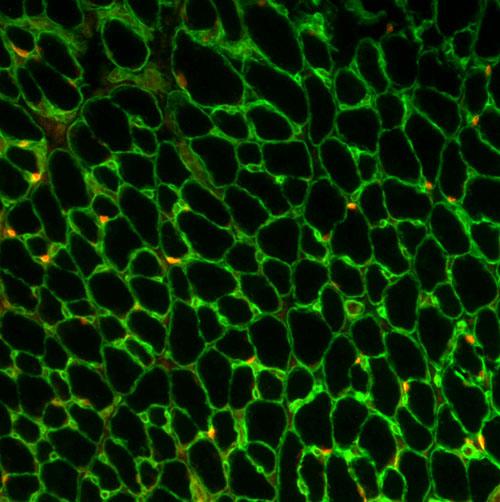
然而,虽然这些下一代细胞疗法即将出现,但仍然存在与干细胞分布相关的重大挑战。心脏中的高血流与各种“组织汇”相结合,循环细胞接触,意味着大多数干细胞最终进入肺和脾。
现在,来自布里斯托尔细胞与分子医学学院的研究人员已经找到了一种方法来通过用特殊蛋白质修饰干细胞来克服这一问题,因此它们可以“归巢”心脏组织。
Adam Perriman博士,研究的主要作者,生物材料副教授,UKRI未来领导者研究员和细胞治疗技术公司CytoSeek的创始人解释说:“通过再生细胞疗法,您在心脏病发作后尝试治疗某人,细胞很少去你想去的地方。我们的目标是利用这项技术重新设计细胞膜,这样当它们被注射时,它们就会回到我们选择的特定组织。
“我们知道,一些细菌细胞含有能够检测病毒组织并使其”回家“的特性。例如,我们口中发现的口腔细菌偶尔会引起链球菌性喉咙。如果它进入血液,它可以”归巢“到受损导致感染性心内膜炎的心脏组织。我们的目的是复制细菌细胞的归巢能力并将其应用于干细胞。“
该团队通过研究细菌细胞如何使用一种称为粘附素的蛋白质来“归巢”心脏组织来开发该技术。利用这一理论,研究人员能够生成粘附素的人工细胞膜结合形式,可以在干细胞外部“涂抹”。在一个动物模型中,该团队能够证明这种新的细胞修饰技术通过将干细胞导入小鼠的心脏而发挥作用。
Perriman博士补充说:“我们的研究结果表明,传染性细菌的心脏归巢特性可以转移到人类干细胞。显着地,我们在小鼠模型中显示设计者粘附素蛋白自发地插入干细胞的质膜而没有细胞毒性,然后在移植后将修饰的细胞导向心脏。据我们所知,这是传染性细菌的靶向特性首次转移到哺乳动物细胞中。
“这项新技术为目前在英国患有心脏病的七百万人带来了巨大的潜力。”
Perriman博士的UKRI未来领袖奖学金基于由Elizabeth Blackwell Institute资助的Catalyst项目资助的研究。他还是布里斯托尔生物设计研究所多学科研究中心BrisSynBio大学的成员,该研究中心专注于合成生物学的生物分子设计和工程方面。
Perriman博士因其在再生工程新型合成生物分子系统的构建和研究方面的开创性研究而闻名。
推荐内容
-
生物制剂与小儿牛皮癣的进一步减少有关
根据2月5日在线发表在《JAMA皮肤病学》杂志上的一项研究,与在现实世界中接受治疗的儿科患者相比,与甲氨蝶呤相比,生物制剂似乎与牛皮癣严
-
宝宝“节后综合症”,调理有新招
孩子是祖国的未来,我们必须时刻关注青少年的身体健康和心理健康。现在社会的压力很大,如果没有一个强大的心脏是无法承受住当今社会的...
-
苍蝇释放神经元制动器以延长飞行时间
虽然对昆虫飞行的机械和生物物理方面进行了充分研究,但其背后的神经生物学和电路仍然知之甚少。对于昆虫而言,虽然肌肉提供飞行的力量...
-
初次约会怎么抓住男人心
21世纪的单身男女对于婚姻总是充满了未知和些许恐惧。好像结了婚就会失去自己的个人自由,实际情况真是如此吗?也不见得,但是现在单身...
-
《今夕何夕》冬月笛子有什么秘密 冬月是怎么穿越的
今天小编来和大家来聊聊有什么电视剧看了第一集就想看第二集的,要说这个电视剧的题材和类型有很多,有家庭伦理剧,悬疑推理剧,战争历...
-
色彩和孩子性格的联系
都说现在的小孩子是越来越难教育了。好像从小就有自己的想法,不听爸爸妈妈的话,有时候还老是对着和你干世界上的色彩是有很多的,有的...
-
心理咨询之婚恋观——女人如何爱护老公_爱护老公的方法
面对现在的社会压力,很多人选择先发展事业再决定谈恋爱结婚这件事。毕竟很多人都觉得爱情可遇不可求,不是说你努力去脱单就能脱单的,...
-
妄想症你患上了吗_什么是妄想症
随着社会压力的不断加大,人们现在把越来越多的目光放到了一个人的心理情况上。确实,每个人的抗压指数是有限的,一个平时看着正常的人...
-
通过改善高风险地区饮用水的处理和质量 可以显着减少蛔虫感染
该研究发现于PloS Medicine的一项为期两年的研究中,该研究调查了水质,卫生,洗手和营养干预对肯尼亚农村肠道蠕虫和贾第虫感染率的影响。
-
脂肪细胞祖细胞亚型可能遵循不同的路径
在不同解剖位置发现的不同种类的脂肪细胞祖细胞可遵循不同的发育途径。通过识别祖先并绘制可能发散或有时甚至会聚的路径,科学家们希望...