使用CRISPR敲入基因的挑战
最重要的是,建造一些东西比撕毁它更难。同样地,敲除基因比敲除它们带来更大的挑战。这是一个现实,研究人员必须克服,以充分利用基因编辑。敲除基因使科学家能够研究特定基因变异的影响,使用绿色荧光蛋白等报告基因在时间和空间上追踪基因产物,探测基因组调控,最终修复导致疾病的基因。“这是一种非常有效的方法来询问基因的每个基因,”华盛顿大学的博士/博士候选人Greg Findlay说。
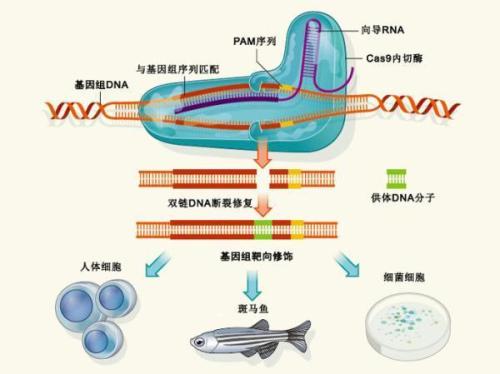
CRISPR-Cas9是一种以其用户友好性着称的基因编辑技术,可以将基因敲入或敲出。敲除基因涉及使用引导RNA将CRISPR-Cas9插入细胞,所述引导RNA将工具靶向感兴趣的基因。在那里,Cas9切割基因,剪断两条DNA链,并且细胞的常规DNA修复机制使用称为非同源末端连接(NHEJ)的过程修复切割。NHEJ高效但不准确。该过程倾向于以小插入或缺失的形式引入错误,这通常足以敲除基因。
然而,为了敲除基因,必须非常精确地修复切口,没有额外的插入或缺失。这需要利用称为同源定向修复(HDR)的第二种DNA修复机制,其在哺乳动物细胞中至少发生效率较低,因此其频率与NHEJ相比相形见绌。使该过程进一步复杂化的事实是一些基因座和细胞类型本质上不太适合CRISPR-Cas9编辑。
在过去几年中,研究人员已经开发出许多新策略来提高使用CRISPR-Cas9敲除大小基因的效率,以及他们提出并测试这种基因编辑的新应用的方式。在这里,科学家探索了一些最有希望的方法。
研究员:赛默飞世尔科技公司合成生物学研发高级主管Jon Chesnut
项目:在开发Thermo Fisher将于今年晚些时候投放市场的名为Truetag的基因标记试剂盒时,Chesnut使用可选标记来提高
效率。选择标记 - 在这种情况下,抗生素抗性基因 - 粘附在荧光蛋白标签上并敲入
哺乳动物细胞中。然后将这些细胞与相关的抗生素一起培养。抗性基因赋予携带它的细胞选择性优势;它们只能生长,因此生长的那些含有感兴趣的基因标签。即使基因插入的效率很低,研究人员也可以使用一周或更长时间的抗生素选择,最终成功插入高比例的细胞。
使用抗生素嘌呤霉素或杀稻瘟素与试剂盒,Chesnut的团队设法在一些细胞群中将基因插入率从10-30%提高到90%或更高。一些特别困难的基因从插入率小于1%到大于90%。在您计划用于寻找正确剂量的细胞系上测试多剂抗生素非常重要,Chesnut说:您希望在没有插入的情况下杀死细胞,而不是在插入成功的情况下杀死细胞。
尝试它:当感兴趣的基因高度表达时,可选择的标记最有效,Chesnut说。“如果不是,你可能仍然可以选择,但你可能无法获得足够的荧光蛋白标签表达以便能够检测到它。”此外,CRISPR-Cas9的一般限制也适用。“基因组中有一些区域与CRISPR切割效果不佳,我们仍然不确定原因,”他补充道。并且一些细胞类型不容易接受外源DNA,RNA或RNA-蛋白质复合物 - CRISPR-Cas9递送的三种方法。
为了更好地插入选择标记,确保有一个所谓的PAM [Protospacer Adjacent Motif]序列,它是CRISPR-Cas9切割前必须识别的靶DNA中的短标签,位于所需基因插入位点的10个碱基对内,Chesnut说。离切割位置更远,插入效率可能太低而无法正常工作。没有PAM站点,您可以尝试使用TALEN或锌指核酸酶,尽管那些较老的基因编辑技术比CRISPR更难。
定时抑制
研究员:Jacob Corn,苏黎世瑞士联邦理工学院基因组生物学家
项目:研究人员不明白为什么NHEJ途径在哺乳动物细胞中远远超过HDR途径。“酵母做HDR就像疯了一样,”Corn说。为了加速人类细胞中的DNA修复过程并改善基因敲入控制,他和他的团队正试图确定HDR的调控方式。他们筛选了人类细胞中的基因,这些基因的敲除导致细胞中HDR增加,然后搜索这些基因的小分子抑制剂。其中一个基因出现了CDC7,一种调节细胞周期过渡到S期的激酶;其抑制剂XL413可将基因敲入效率提高两到三倍(BioRXiv,DOI:10.1101 / 500462,2018)。这是因为HDR只发生在细胞周期的某些部分,包括S期,Corn说。如果您在使用CRISPR-Cas9编辑目标基因的同时添加抑制剂XL413,则细胞会在S阶段之前的阶段堆积。然后你移除XL413,所有细胞都进入S阶段,提高了敲入效率。
玉米在许多永生化的人细胞系和人类T细胞中使用了这种技术。它可以敲入短链DNA,如SNP,以及大基因。他说,没有理由不应该在老鼠身上发挥作用,尽管他没有对它进行测试。
试一试:“时间绝对是关键,”Corn说。Cas9必须在添加XL413的同时切割DNA。如果您在使用CRISPR-Cas9进行编辑时首先进行抑制然后释放,则同源重组效率会下降三倍而不是增加,因为细胞会释放到细胞周期的错误阶段。
与任何HDR努力一样,Corn表示,总是运行无核酸酶控制,以确保您不会意外地放大在实验室中漂浮的污染DNA。他说,在引入敲入后,“序列,序列,序列,序列”。只需使用荧光蛋白标签等报告系统来证明成功插入基因就可能适得其反。测序验证插入是在正确的位置进行的。
玩长游戏
研究员:内布拉斯加大学医学中心小鼠基因组工程核心设施主任Channabasavaiah Gurumurthy
项目:几年前,Gurumurthy和他的同事们在试图将这些基因敲入基因的过程中考虑进入小鼠受精卵时有一个启示。
研究人员成功地插入了短链单链DNA,为什么不尝试通过插入长的单链DNA进行敲入?实际上,Gurumurthy称之为Easi-CRISPR(使用ssDNA插入物-CRISPR的有效添加物)的方法将效率提高了2.5倍,并且使用单链DNA在细胞培养中削减了脱靶插入率100倍(Nat Protoc)13:195-215,2018;Nature559:405-09,2018)。“这是非常巨大的,”他说。在Gurumurthy的实验室中,Easi-CRISPR已经为他们尝试过的每10个基因中的9个产生了一个敲入式鼠标系。合作者还在人类T细胞中使用它来制造CAR-T细胞,这是一种用于对抗癌症的患者特异性免疫细胞。
尝试一下:Gurumurthy警告说,Easi-CRISPR远非万无一失。有时该技术仅插入部分基因。此外,他补充说,它可以扰乱同源臂 - 基因任一侧的短序列,将其置于基因组中的正确靶标。并且一些基因座比其他基因座更难以插入。
很少有商业供应商设计和合成定制的长链单链DNA。你可以自己做,但单链DNA的稳定性各不相同;Gurumurthy说,不太稳定的序列会产生较低的产量,因此你可能需要合成更多的序列。
Gurumurthy说,无法将CRISPR插入单细胞小鼠胚胎的研究人员可以为核小鼠提供核心设施。核心设施,例如他从5,000美元到15,000美元的费用,以产生一对或两对繁殖对;他说,商业设施收费2万至5万美元。
数字敲门
研究员:Greg Findlay,华盛顿大学Jay Shendure实验室的博士/博士候选人
项目:芬德利和他的同事们的目标是改善临床医生如何解释乳腺癌和卵巢癌基因BRCA1的突变。该基因有数千种变异,但研究人员并不知道它们中的大多数会影响其功能。为了研究这些变体的影响,他们使用了他们开发的称为饱和基因组编辑的敲入技术。
在永生化单倍体人细胞系中,他们使用CRISPR-Cas9在体外一次敲入数百万个细胞中的4,000个微小变体。基因组在每个细胞中的相同位置切割,但每个细胞的基因组接收不同的变体。为了促进HDR,他们还敲除了连接酶4Findlay说,该基因阻碍了NHEJ修复途径 - 这一步骤使效率提高了三倍。最后,由于所有细胞的敲入不同,它们对细胞进行了深度测序,覆盖了相同的基因组区域数百万次,以确保它们实际上敲入了他们想要研究的4,000种变体。他们在两个时间点进行测序,并推断出在第二时间点测序中未出现的敲入物是干扰基因功能的敲入物,因为携带它们的细胞必定已经死亡。
尝试一下:Findlay的团队在微阵列上为他们制造了4,000种变体的DNA寡核苷酸。Findlay表示,你可以购买6,000到250,000个寡核苷酸的阵列,因此可以考虑通过在同一阵列上组合多个实验来获得更多收益。他们的实验室为100,000个寡核苷酸支付了大约5,000美元。
该策略具有局限性:迄今为止仅用于敲入单核苷酸变体,并且所有编辑都需要在同一基因中。Findlay说,当编辑相当狭窄的DNA区域(大约110-120个碱基对)时,该方法效果最佳,因为较长的DNA寡核苷酸会产生太多错误。同样重要的是要非常深入地排序以确保您考虑到您想要敲入的全部变体。
推荐内容
-
心理咨询之婚恋观——【女人失恋后的极端心理】女人失恋后的心理
爱情和婚姻本身是美好的东西,但是因为每个人处理的方式不同导致结果有好有坏。很多人其实可以少看一些网络案例,毕竟感情这种事是很难...
-
心理咨询之婚恋观——【男人挑老婆的指标】男人挑老婆的指标有哪
面对现在的社会压力,很多人选择先发展事业再决定谈恋爱结婚这件事。毕竟很多人都觉得爱情可遇不可求,不是说你努力去脱单就能脱单的,...
-
当心“听话孩子”的心理损伤
都说小孩一天一个样。其实从小到大的成长过程中每个人都在不断的“进化”无论是在学校里,还是在家里,受关注的永远都是最调皮捣蛋的孩...
-
研究人员发现了抗击自身免疫的新分子靶点
BRCA-与乳腺癌,卵巢前列腺癌和胰腺癌相关的DNA修复蛋白家族 - 与多部分分子复合物相互作用,该复合物也负责调节免疫系统。当该途径中的
-
有希望的疟疾疫苗将在第一次大型田间试验中进行测试
可以在大型临床试验中首次测试可以提供高达100%的抗疾病保护作用的疟疾疫苗,以研究其在真实条件下的功效。该试验将于2020年初在赤道几内亚
-
非药品撤离药店 又一波整治来了
国家医保局又发文,针对药店套刷医保倒卖非药品展开行动,为期7个月。不少地方医保药店嗅到烟火味,将非药品撤离药店。医保局发文,持续高
-
心理咨询之婚恋观——维持新鲜感方法_如何维持新鲜感
现在的年轻人对于婚姻和爱情大部分是很被动的,他们觉得感情这种事随缘就好,其实一个人也可以过的很精彩。但是没经历过你又怎么知道爱...
-
小气的人是什么心理
社会的发展越来越快,大家现在也慢慢开始关注一个人的心理健康。因为外界事物的巨大变化,很多人跟不上变化的脚步就会产生心理落差感从...
-
什么肥胖的果蝇可以告诉我们耐寒性的演变
研究人员假设,迁移到更高,更冷的纬度可能会导致快速燃烧的代谢物的进化,使细胞在寒冷的条件下保持温暖,从而提高耐寒性。4月10日,在发
-
新研究表明 身体活动可以降低心脏损害的风险
根据一项新的研究,身体活动可以降低中老年人心肌损害的风险,并降低肥胖人群的心肌损害水平。研究背后的团队说:身体活动与降低心衰风...