睡眠和衰老与氧化应激的关系
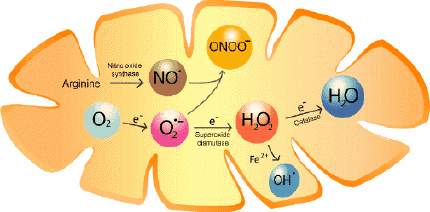
在喝了一种神秘药水后,Rip Van Winkle睡了20年,终于醒了一个老人。如果它被标记为“氧化应激”,也许他会避免使用魔药,这是指与生命,衰老和退行性疾病有关的线粒体活性副产物。科学家现在报道,氧化应激通过离子传输通道影响睡眠控制神经元,这些通道被命名为Sandman和Shaker。
根据牛津大学的科学家的说法,关于氧化应激的新发现使我们更接近了解睡眠是如何被调节的,开发治疗睡眠障碍的新药物,以及确认长期睡眠不足和寿命缩短之间的可疑联系。
“氧气罐带有爆炸危险标签并不是偶然的:不受控制的燃烧很危险,”负责牛津团队的神经电路和行为中心主任兼Waynflete生理学教授GeroMiesenböck博士说。“动物,包括人类,在使用他们呼吸的氧气将食物转化为能量时面临着类似的风险:不完全包含的燃烧导致细胞中的”氧化应激“。
“这被认为是导致衰老的原因,也是导致我们晚年衰退的退行性疾病的罪魁祸首。我们的新研究表明,氧化应激也会激活控制我们是否进入睡眠状态的神经元。“
这项新研究发表在3月21日的“自然”杂志上,题为“钾通道β-亚基偶联线粒体电子传递到睡眠中。”文章描述了牛津团队如何研究果蝇睡眠的调节 - 动物近50年前,它还提供了对生物钟的第一次见解。每只苍蝇都有一套特殊的睡眠控制神经元,脑细胞也存在于其他动物身上,并被认为存在于人体中。
“在果蝇果蝇中,”文章解释说,“大约二十多个睡眠诱导神经元向背扇形体(dFB)投射,通过对两种钾电导的拮抗调节来调节它们的电输出以满足睡眠需求:泄漏通道桑德曼在清醒期间施加沉默,而通过振荡器增加的A型电流在睡眠期间支持强力射击。
在先前的研究中,Miesenböck及其同事发现dFB神经元的作用就像一个开关:如果神经元是电活动的,那么苍蝇就会睡着;当他们沉默时,苍蝇醒着。
“我们表明线粒体电子传递的氧化副产物通过与ShakerKVβ亚基的氧化还原酶结构域结合的烟酰胺腺嘌呤二核苷酸磷酸(NADPH)辅因子调节dFB神经元的活性,Hyperkinetic,”新的研究表明。“睡眠丧失会升高dFB神经元中的线粒体活性氧,通过将Hyperkinetic转换为NADP+结合形式来记录这种上升。辅助因子的氧化减缓了A型电流的失活,增加了动作电位的频率,从而促进了睡眠。
Shaker和Sandman通道产生并控制脑细胞通信的电脉冲。睡眠和清醒之间的主要区别是有多少电流流过Shaker和Sandman。在睡眠期间,大部分电流都通过Shaker。
“这变成了一个棘手的大问题'我们为什么要睡觉?'一个具体的,可解决的问题,“当前研究的共同作者之一Seoho Song博士说。“是什么原因导致电流流过Shaker?”
该团队在Shaker频道的一个组件中找到了答案。
“悬浮在Shaker导电部分下面的是另一部分,就像热气球下的缆车一样,”牛津大学博士后的主要作者Anissa Kempf博士指出。“吊舱中的乘客,小分子NADPH,在两种化学状态之间来回翻转 - 这调节了振荡器的电流。反过来,NADPH的状态反映了细胞经历的氧化应激程度。失眠会导致氧化应激,从而推动化学转化。“
在这种机制的一个引人注目的证明中,闪烁的NADPH化学状态的闪光让苍蝇入睡。
根据Miesenböck的说法,同样改变Shaker-NADPH化学成分的药物可能是一种强效的新型安眠药:“睡眠障碍很常见,安眠药是最常用的处方药之一。但是现有的药物存在混乱,健忘和成瘾的风险。针对我们发现的机制可以避免一些副作用。“
推荐内容
-
《斗罗大陆》动画举办三周年生日会 惊喜发布2021特别篇、斗罗女团
这两天各大卫视的招商发布会搞得轰轰烈烈,连续三天四场招商会看得观众眼花缭乱。除了各种五花八门的真人秀陆续揭晓,各种年度大剧也成...
-
不同年龄段的宝宝都在害怕什么
都说现在的小孩子是越来越难教育了。好像从小就有自己的想法,不听爸爸妈妈的话,有时候还老是对着和你干害怕或恐惧是人的本能,虽然宝...
-
如何辨别男人是否撒谎
生活中,不管我们在跟自己独处还是跟别人相处的过程中其实我们会发现心理对一个人的影响是很大的。因此当我们发现自己有心理疾病的倾向...
-
透视宝宝的喜怒哀乐
都说小孩一天一个样。其实从小到大的成长过程中每个人都在不断的“进化” 婴儿的情绪最初有两种反应:一种是愉快,
-
为什么小孩喜欢吃零食
一个人的性格跟他从小成长的环境分不开。父母亲的教育尤为重要,将会影响孩子的一生。为什么小孩喜欢吃零食1、小孩喜欢吃零食是出于好奇和
-
性别和饮食特异的蛋白质组差异杰出
旧的自然与培育的想法正在获得一个新的维度,礼貌的蛋白质组学,一个致力于蛋白质组的全面表征的科学学科,个体生物或细胞内的蛋白质宇...
-
正确面对孩子的争强好胜
儿童小时候经常会有一些心理方面的小变化。这时候非常考验家长的观察能力。根据小孩子的细微变化家长也要不断调整自己的教育模式和方法...
-
心理咨询之婚恋观——【为何男人婚后不疼你】男人婚后不疼你的原
面对现在的社会压力,很多人选择先发展事业再决定谈恋爱结婚这件事。毕竟很多人都觉得爱情可遇不可求,不是说你努力去脱单就能脱单的,...
-
用烟头烫手臂是什么心理
生活中,不管我们在跟自己独处还是跟别人相处的过程中其实我们会发现心理对一个人的影响是很大的。因此当我们发现自己有心理疾病的倾向...
-
影响婚姻幸福有什么因素
每个人对爱情和婚姻或多或少都有自己的想象,但是实际上遇到爱情来临的时候很多人又不知道该怎么处理,所以感情也是门深奥的学问,大家...