线粒体呼吸超复合物的完整结构解码
逐个片断,线粒体中电子传递的电路图已经接近完成。为五个呼吸复合体中的任何一个获得的每个新结构进一步限制组装的拼图。最终,大块被安排到他们的最终位置。最大块的确切成分,即所谓的megacomplex,长期以来一直没有得到研究人员的支持。现在,在将140个单独的子单元成像到3.9欧姆分辨率之后,Full Monty已经裸露。研究人员在Cell中详细描述了人类呼吸巨型复合体是如何组合在一起并且似乎起作用的。
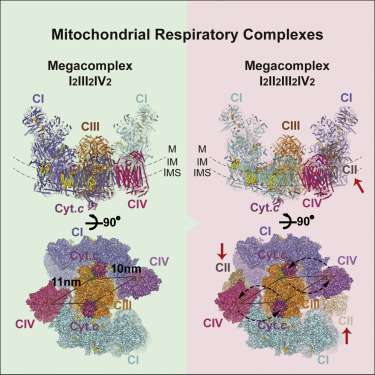
简单的日子已经一去不复返了。没有更多的原始图表,复合物在膜中排成一排,从1到5,电子和它们的移动载体依次从左到右穿过。带上化学计量,然后带上2-D。化学计量意味着实际上,每个复合物实际上在特定拷贝数的megacomplex中表示。这些额外的副本需要以任何准确的表示方式进入某处。不仅如此,较小的电子载体需要一个空间来悬挂。它们还需要存在于通道中,这些通道要么保留在megacomplex的本地,要么可能扩散到其他通道。最终的几何形状将决定单独的电子路径合并或分叉的位置,以及它们最有可能反向运行的位置。
已经出现的megacomplex(MC)的图片具有以下化学计量:MCI2II2III2IV2。这意味着络合物I,II,III和IV各自一式两份存在,而络合物V不存在。它在膜内配置成环状结构,二聚体CIII位于中心并由外周C1和CIV复合物供给。CII复合物显然不是核心结构的基本要求,而是理论上根据需要楔入间隙。作者还发现了一个轻量级的megacomplex演绎的证据,有时可以只用一个CI复合体组装。
CIV二聚体的中心定位表明了一定的逻辑。CIV或细胞色素氧化酶是电子进入链的末端静止基质。那些能够实现这一目标的人已经尽可能地降低了减少潜力等级。在这里,它们沉入等待的氧分子中,然后氧分子作为水分子被耗尽。封装为NADH的高电位电子在其周边进入复合体并进入中心。C5配合物的缺失可能并不那么罕见,因为它们通常被发现为“V”形二聚体的行,其将膜扭曲成在cristea弯曲处的高曲率区域。
有了基本结构,研究人员就能够提出一些基本的操作原理。它们包含和放置CII有效地解释了从琥珀酸到NADH的反向电子传递。所提出的几何形状还产生密封的Q-池(脂溶性电子载体),其可被CI和CII接近。作者还能够确定几种脂质分子的特性和位置,这些脂质分子将复合物固定在膜内,特别是磷脂酰乙醇胺,磷脂酰胆碱和心磷脂的几种关键分子。他们还能够识别优选的或最有效的电子传递途径,这反过来又限制了在活性载体之间可以同时传输多少电子。
这项新工作的直接好处之一是,许多以前未完全了解的呼吸道蛋白致病突变现在都有意义。在拥有任何megacomplex结构之前,研究人员别无选择,只能专注于突变如何影响单个复合物的结构或功能。事实证明,核心亚基Ci和CIII靶标中记录的大多数突变位于复合物之间蛋白质 - 蛋白质相互作用位点的残基中。(例如,CI中的亚单位NDUFV1,NDUFS1,ND1,ND5和ND6以及CIII中的亚单位MT-CYB中的疾病相关突变)。这显示了在没有更大图景的情况下试图仅查看单个蛋白质和亚基的徒劳无益。
应该提到的是,根据研究的器官和物种,先前确定呼吸复合物化学计量的努力获得了略微不同的结果。已经研究过马铃薯,牛,羊和酵母,它们并不总是具有CI复合体。不同的情况可能需要不同的化学计量和形式,这并不奇怪。不同的megacomplex结构对于底物通道,催化增强,活性中间体的隔离或结构稳定化具有不同的优点。一项专门研究心脏线粒体的研究设定了氧化磷酸化复合物I:II:III:IV:V的比例为1:1.5:3:6:3。在这种情况下,作者称他们的复合体为“respirasome”。
现在可能已经破裂了呼吸型巨型复合体,向下迈出的一大步是将线粒体双膜系统的其他一些上层结构推入模型中,以预测为什么cristea看起来像他们一样。大量的TIM-TOM导入复合物跨越两个膜,并与转化线粒体蛋白的mitoribosome密切相关。反过来,mitoribosomes定位于底层膜相关的核仁,其中包含mtDNA的拷贝。通过与核的核仁类比,这种复合的核 - 核糖体结构被称为'线粒体。'其他关键的进口复合物是竞争关键的膜房地产的混合物。麦芽酸 - 天冬氨酸穿梭,为例,是大脑中最重要的穿梭,平衡线粒体和细胞质之间的主要代谢物。用于脂肪酸合成的柠檬酸盐 - 丙酮酸盐梭和甘油磷酸盐梭(至少对于棕色脂肪和昆虫飞行肌肉)也必须找到能够与邻近的邻居相处的家园。
蛋白质在这些巨型结构中的地方性组织表明,线粒体可能比流体原生质更像硬质晶体。然而不知何故,它们在融合和裂变方面显得非常柔顺。在这些变化下,它们的膜结构会发生什么变化?在有丝分裂过程中,复合物是否会像常规细胞的原生纤毛和中心粒一样暂时分解和溶解?工作中出现了一条引人入胜的新线索,表明线粒体通过自身结构的“纳米管”相互连接。这些纳米通道与细胞骨架注入的“隧道纳米管”品牌完全不同(据我们所知)细胞自身用来将整个线粒体相互转移。
Martin Picard及其同事在细胞生物学趋势中最近的一篇综述表明,当线粒体固定在细胞骨架上时,这些纳米管可能形成一种方式。如果像驱动蛋白这样的运动蛋白能够获得固定线粒体的片段,那么当驱动蛋白运动对抗另一个微管时,它可以拉出薄的纳米管。线粒体的僵硬体及其膜结构可能保持完整。然后,这种投射可能遇到另一个与其相连的线粒体。
皮卡德此前表明,心肌内约有一半的线粒体具有间歇性线粒体连接(IMJ)和嵴,它们排列成延伸到线粒体网络的规则模式。最近的裂变事件不太可能产生这种不可思议的网络对齐,因为心脏线粒体固定在适当位置并显示出最小的裂变/融合动力学。最近已经证明IMJ通过在其自身膜去极化时快速解偶联连接的线粒体来控制收缩性。这里有一件重要的事情就是重新检查人类心脏线粒体中的呼吸亚单位化学计量补充这里报道的人胚胎肾细胞的结果。
推荐内容
-
教养方式影响孩子交往心理
孩子是祖国的未来,我们必须时刻关注青少年的身体健康和心理健康。现在社会的压力很大,如果没有一个强大的心脏是无法承受住当今社会的...
-
研究人员开发可穿戴式微流式细胞仪
罗格斯大学新不伦瑞克分校的研究人员创建了一种可穿戴的微流控阻抗细胞仪,可与智能手机建立无线连接。他们的技术可以添加到手表和其他...
-
心理咨询之婚恋观——【女人不再爱你的表现】女人不再爱你的表现
每个人对爱情和婚姻或多或少都有自己的想象,但是实际上遇到爱情来临的时候很多人又不知道该怎么处理,所以感情也是门深奥的学问,大家...
-
心理咨询之婚恋观——男人怎样伤女人心_男人伤女人心的话
爱情和婚姻是不一样的两个东西。爱情更多的是种冲动,而婚姻是责任。爱情应该多以自己的想法和角度出发去感受,而婚姻必须考虑到双方的...
-
新型蛋白质CPTP为癌症和其他疾病的治疗带来希望
来自美国,俄罗斯和西班牙的一组研究人员表示,一种名为神经酰胺1磷酸转运蛋白的新蛋白的发现,可能会导致开发用于治疗多种癌症和其他疾病
-
如何缓解孩子开学前紧张?
都说现在的小孩子是越来越难教育了。好像从小就有自己的想法,不听爸爸妈妈的话,有时候还老是对着和你干案 例一到开学前就喊不舒服雍华府
-
桐树基因突破肿瘤ctDNA精准检测技术关键壁垒
伴随基因科技的进步,基因检测在医疗健康领域的应用越来越广泛,是当前生物科学领域最具发展前景的产业之一,也已成为国家发展的重要战...
-
心理咨询之婚恋观——优质男单身原因_优质男择偶标准
每个人对爱情和婚姻或多或少都有自己的想象,但是实际上遇到爱情来临的时候很多人又不知道该怎么处理,所以感情也是门深奥的学问,大家...
-
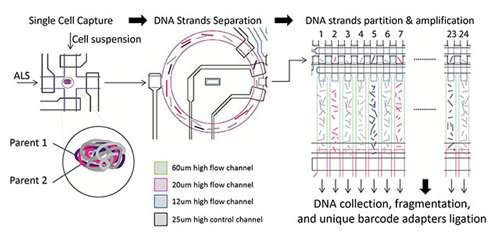
科学家们创造了用于单个人类细胞的超精确基因组测序的装置
加州大学圣地亚哥分校的一个跨学科研究团队开发了一种技术,用于对来自单个人类细胞的基因组进行非常准确的测序和单元型分析。他们的研...
-
青少年存在什么心理问题
心理活动是每个人都有的。然而这样一个别人不知道的思想角落,往往容易被他人忽视。所以我们自身必须时刻关注自己的内心需求,不能让自...